Cientistas da Escola de Medicina de Stanford fizeram um avanço importante que abre novas possibilidades para medicamentos que controlam a liberação de neurotransmissores.
Neurotransmissores são substâncias químicas que permitem o impulso nervoso de um neurônio a outro. Eles têm a função de biossinalização, enviando informações a outras células. Ou seja, eles atuam como mensageiros químicos.
O que os cientistas descobriram ao mapear a estrutura atômica em 3D de um complexo de duas proteínas, foi como este complexo controla a liberação dos neurotransmissores em menos de um milésimo de segundo.
Os experimentos foram divulgados ontem (17 de agosto) no journal Nature. Realizados na Linac Coherent Light Source (LCLS) e no SLAC National Accelerator Laboratory, os experimentos levaram décadas de pesquisas.
Axel Brunger, principal pesquisador e professor na Escola de Medicina de Stanford e na SLAC e, ainda, pesquisador do Instituto Médico Howard Hughes afirma que essa descoberta pode ajudar no tratamento de muitos transtornos mentais, como depressão, esquizofrenia e ansiedade, já que afetam os sistemas de neurotransmissores.

A partir da esquerda, Axel Brunger, Artem Lyubimov, Qiangjun “John” Zhao e Zhou Minglei visualizam as imagens do experimento. Os pesquisadores usaram uma configuração robótica, cristais congelados (a tela no canto superior esquerdo mostra um cristal) e uma série de pulsos de raios-X. Eles analisaram as imagens destes cristais para determinar a estrutura em escala atômica de um complexo de proteínas que fornece pistas de como nosso cérebro envia mensagens químicas de forma rápida. Crédito: SLAC National Accelerator Laboratory
As duas proteínas mapeadas são conhecidas como SNARE e synaptotagmina-1. “Ambas fazem parte do complexo protéico e são essenciais, mas até agora não estava claro como estas duas peças trabalhavam juntas” disse Brunger.
A SNARE – um feixe helicoidal de proteínas – desempenha um papel chave na sinalização química do cérebro ao juntar, ou “fundir”, pequenos pacotes de neurotransmissores nas bordas dos neurônios, onde são liberados e, em seguida, encaixados com receptores químicos em outro neurónio para desencadear uma resposta.
Acionamento rápido da sinalização cerebral
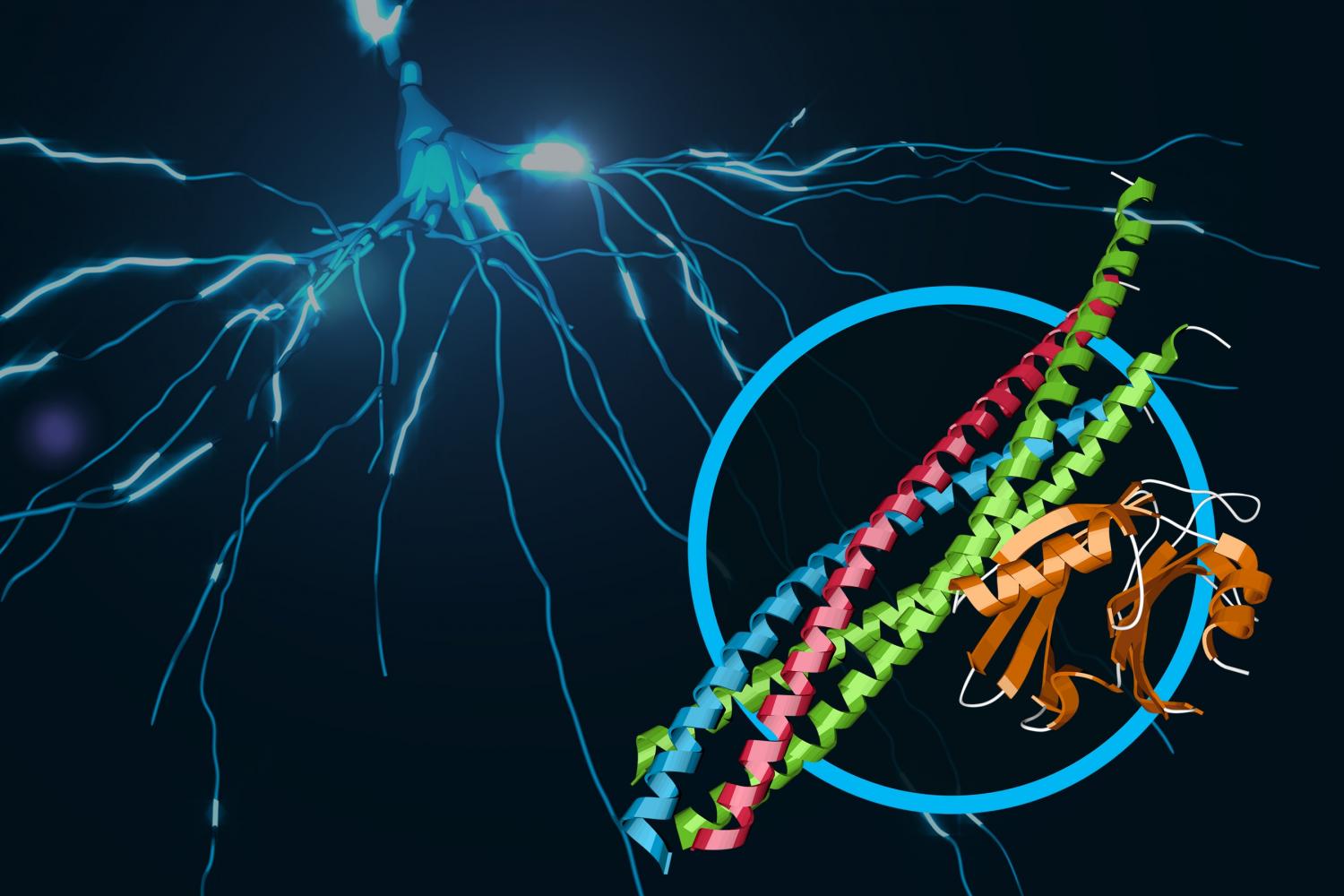
Esta ilustração mostra um complexo de proteínas trabalhando na sinalização cerebral. Há dois complexos de proteínas: SNARE, mostrada em azul, vermelho e verde, e a synaptotagmina-1, em laranja. O complexo combinado é responsável pela liberação de cálcio em um processo chamado fusão das vesículas sinápticas. Ao fundo, os sinais elétricos viajam através de um neurônio. (SLAC National Accelerator Laboratory)
Nesta última pesquisa, os cientistas descobriram que quando as SNARE’s e a synaptotagmina-1 se juntam, há um ligeiro aumento na concentração de cálcio, provocando uma liberação rápida de neurotransmissores de um neurônio para outro. Eles também descobriram que as proteínas se unem antes de chegar à membrana de um neurônio, o que ajuda a explicar como elas desencadeiam a sinalização do cérebro tão rapidamente.
A equipe especula que vários complexos unidos de proteínas podem agrupar-se e interagir simultaneamente para acionar, de forma eficiente, a liberação de neurotransmissores. “A estrutura do complexo SNARE-synaptotagmina-1 é um marco esperado por um longo tempo, e estabelece um quadro para uma melhor compreensão do sistema”, disse James Rothman, professor da Universidade de Yale, que descobriu as proteínas SNAREs, ganhando o Prêmio Nobel 2013 em Fisiologia e Medicina.
Thomas C. Südhof, que também ganhou junto com Rothman o Prêmio Nobel 2013, descobriu como a synaptotagmin-1 desempenha um papel importante como um sensor de cálcio e como gatilho de cálcio para liberação do neurotransmissor.
“A nova estrutura identificou as interfaces entre a synaptotagmina-1 e o complexo neuronal SNARE mudando a forma como pensávamos sobre essa interação e revelando em detalhes atômicos, exatamente onde elas se juntam”, disse Sudhof. “Este é um novo conceito que vai muito além dos modelos anteriores de como funciona synaptotagmina-1.”
Cristais, robótica e laser de raios-X para o avanço da Neurociência

Equipamento utilizado na Linac Coherent Light Source da SLAC para o estudo. O tambor de metal no canto inferior esquerdo contém nitrogênio líquido para resfriamento das amostras cristalizadas que foram estudadas. Crédito: SLAC National Accelerator Laboratory
Para estudar essa estrutura unida da proteína, os pesquisadores encontraram uma maneira de aumentar os cristais deste complexo. Eles usaram um sistema robótico desenvolvido na SSRL para estudar estes cristais. Também usaram laser de raio-X, que é uma das fontes mais brilhantes de raios-X do planeta. Os pesquisadores combinaram e analisaram centenas de imagens de raios-X de cerca de 150 cristais de proteínas para revelar detalhes em escala atômica da estrutura unida.
Esta experiência foi a primeira na LCLS a usar uma plataforma robótica altamente automatizada. O estudo também foi apoiado por experimentos de raios-X na SSRL e pelo Argonne National Laboratory.
Brunger disse que estudos futuros deverão explorar outras interações relevantes entre proteínas para a liberação de neurotransmissores. Para ele, há muitos outros fatores que interagem com este sistema e eles querem entender.
A pesquisa também foi apoiada pelo Instituto Médico Howard Hughes, pelo National Institutes of Health (NIH), pelo DOE Science Office, e pelo Programa de Biologia Molecular Estrutural da SSRL.
Fonte: Nature via KurzweilAI